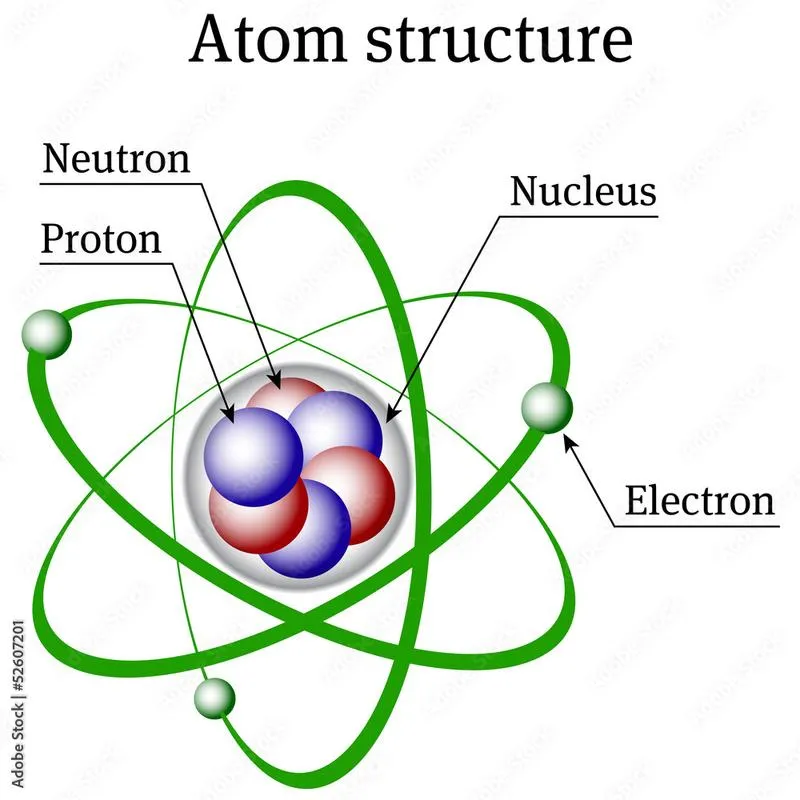
Atom, będący małym, ale niesamowicie istotnym fragmentem materii, przypomina zupę ogórkową w przepisie na życie – jest podstawowym składnikiem, dzięki któremu nie da się stworzyć nic pysznego. Atomy, jako najmniejsze jednostki pierwiastków chemicznych, fascynują nas swoją zdolnością do łączenia się w różnorodne konfiguracje, przez co tworzą wszystko, co nas otacza. Wyobraź sobie atom jako drobną kuleczkę z jądrem w centrum, do którego przylegają krążące niczym szaleni tancerze elektrony. Choć te cząstki są mikroskopijne, odgrywają kluczową rolę w zrozumieniu funkcjonowania naszego wszechświata.
W centrum całego procesu znajduje się jądro atomowe, składające się z protonów i neutronów. Protony, które mają dodatni ładunek, decydują o tym, do jakiego pierwiastka chemicznego należy dany atom, ponieważ ich liczba w jądrze jest kluczowa. Z kolei neutrony, podobnie jak sąsiedzi, którzy zazwyczaj nie wtrącają się w sprawy obcych, posiadają ładunek neutralny i przyczyniają się do stabilności jądra. Dlatego można z łatwością obalić twierdzenie kogoś, kto mówi, że w atomie brak neutronów, ponieważ ich obecność jest niezbędna dla zachowania równowagi sił!
Cząstki atomowe w detalach
A teraz czas na szczegóły: elektrony, te figlarne cząsteczki znane jako „zaangazowane”, krążą wokół jądra na różnorodnych orbitalach, a ich liczba dokładnie odpowiada liczbie protonów w obojętnym atomie. To właśnie dzięki tej równowadze atomy mogą swobodnie się przemieszczać, łączyć oraz tworzyć różne substancje. Współczesna chemia opiera się na tych fundamentalnych zasadach, dlatego zrozumienie atomów stanowi klucz do analizy reakcji chemicznych. Opisujemy je za pomocą liczby atomowej (informującej o protonach) oraz liczby masowej (suma protonów i neutronów). Wygląda na to, że nauka dysponuje swoimi „numerami”, by poznawać każdy aspekt tych malutkich stworków!
Podsumowując, atomy mogą wydawać się mikroskopijne i nieważne, ale w rzeczywistości przypominają tajnych agentów, którzy spiskują przeciwko chaotycznemu światu, w którym żyjemy. Każdy z nich odgrywa określoną rolę – od budowli, przez udział w reakcjach chemicznych, aż po tworzenie układów okresowych, które starannie porządkują naszą wiedzę o materii. W tym zwariowanym świecie atomów to właśnie one odpowiadają za kolory, smaki, a nawet zapachy! Więc gdy następnym razem sięgniesz po szklankę wody lub posmakujesz ulubionych ciasteczek, pamiętaj, że wszystko to zbudowane jest z tych tajemniczych i niezwykle sprytnych atomów.
Podstawowe pojęcia kwantowej teorii atomu: zrozumienie niepewności i dualizmu

Kiedy zagłębiamy się w kwantową teorię atomu, odkrywamy, że atom przypomina nie tylko małą kulkę na górce, ale również całą galaktykę mikroskopijnych cząstek! W samym centrum atomu znajduje się jądro, wypełnione protonami i neutronami, a wokół niego w chaotycznym tańcu krążą elektrony. Jednak zatrzymajmy się na moment, aby przemyśleć te rewelacje! Już w XIX wieku John Dalton wprowadził nas w błąd, twierdząc, że atomy mają postać jednorodnych kul. Wszystko zaczęło się zmieniać, gdy odkryliśmy, że sprawa jest znacznie bardziej skomplikowana: to przypomina układ solarny, tylko w dużo mniejszej skali i z dodatkowymi, zwariowanymi detalami!
Niepewność – Przyjaciel i Wróg
W miarę jak wkraczamy na terytorium niepewności, dostrzegamy, że rzeczywistość atomowa działa na zupełnie innych zasadach. Dzięki Wernerowi Heisenbergowi odkrywamy świat, w którym nie potrafimy dokładnie określić lokalizacji elektronu ani jego prędkości. Zamiast tego dostrzegamy „chmurę” elektronów, a to oznacza, że możemy mówić jedynie o prawdopodobieństwie ich obecności. Tak więc, jeśli zgubiłeś klucze do swojego mieszkania, wyobraź sobie, że te klucze znajdują się w „niewidocznej chmurze” w twoim salonie – niby tam są, ale nigdy nie wiesz, gdzie dokładnie!
Dualizm – Superbohaterów atomowego świata
Gdy już myślimy, że pojęliśmy koncepcję atomu, do gry wchodzi dualizm. Elektrony posiadają zdolność bycia zarówno cząstkami, jak i falami. To przypomina sytuację, w której próbujesz złapać rybę w sieci i jednocześnie kręcisz się na hulajnodze – zupełny absurd, ale w świecie mikroskopijnym to norma! Albert Einstein oraz inni naukowcy zasugerowali, że cząstki subatomowe mogą mieć różne oblicza w zależności od sposobu ich obserwacji. To nic innego jak wielowymiarowa gra w szachy, gdzie każde posunięcie odkrywa nowe rzeczy, które wcale nie wyglądają tak, jakbyśmy się tego spodziewali.
Na koniec tej zwariowanej podróży stawiamy pytanie: czy rzeczywiście potrafimy zrozumieć ten niezwykły świat? Może nie we wszystkim, ale na pewno daje nam to powód do śmiechu oraz motywację do odkrywania nowych tajemnic atomowego bractwa. W związku z tym, gdy na lekcji chemii ktoś wypowie słowo „atom”, wyobraź sobie całą fabułę tej „ukrytej powieści”, która umyka wzrokowi! Jak to mówią – życie pełne jest niespodzianek, zwłaszcza w kontekście subatomowych cząstek!
Poniżej znajdują się kluczowe koncepcje związane z atomami i ich naturą:
- Atom jako jednostka budulcowa materii
- Jądro atomowe składające się z protonów i neutronów
- Elektrony krążące wokół jądra
- Niepewność Heisenberga dotycząca pozycji elektronów
- Dualizm cząstek subatomowych i ich oblicza
Interakcje atomowe: jak atomy łączą się i współdziałają w chemii
Interakcje atomowe przypominają niewidzialną sieć relacji, łączącą wszystkie atomy i kształtującą nasz znany świat. Wyobraźcie sobie, że każdy atom funkcjonuje jak uczestnik imprezy, gdzie niektórzy tańczą sami, a inni w parach lub w większych grupach. Klucz do tej tanecznej układanki znajduje się w sposobie, w jaki atomy się łączą, co głównie zależy od ich elektronów. Te małe cząstki znajdują towarzyszy w różnych konfiguracjach, tworząc wiązania chemiczne. Kiedy państwo kupujecie ten cudowny ciuch w sklepie, na pewno doceniacie te atomowe przyjaźnie, które się za nim kryją!
Jak atomy tworzą wiązania chemiczne
Atomy łączą się na dwa główne sposoby: tworząc wiązania kowalencyjne lub jonowe. W przypadku wiązań kowalencyjnych atomy dzielą się swoimi elektronami, niczym przyjaciele dzielący się ostatnim kawałkiem pizzy. Na przykład dobrze znany węgiel układa się z innymi atomami, tworząc organiczne związki niezbędne dla życia. Z drugiej strony, podczas tworzenia wiązań jonowych jeden atom "pożycza" elektron od drugiego i już nie odpuszcza! Powstają jony, które przyciągają się nawzajem jak magnesy, a w efekcie otrzymujemy sól. W końcu nikt nie twierdzi, że chemia nie może być smaczna!
Jednak to wciąż nie wszystko! Atomy to także małe, ale jakże zgubne stwory! Dzięki atrakcyjnym różnicom ładunków elektrycznych, zapewniają nam to, czego potrzebuje cały chemiczny bal - energię. Różnice te nazywamy ładunkami elektrycznymi i są one powodem, dla którego atomy prezentują różne zachowania. Niektóre z nich są stabilne i spokojne jak leniwe koty, podczas gdy inne chętnie zapraszają do swojego grona wszystkie inne atomy, by stworzyć coś nowego!

Na koniec warto zwrócić uwagę na atomowych tancerzy – elektrony, które biorą udział w tworzeniu wiązań oraz decydują o chemicznych właściwościach pierwiastków. Obszar wokół jądra, w którym krążą te szalone cząstki, nazywa się powłoką elektronową. Cóż, to tak, jakby wrzucić do miksera kardiowalantów (wybaczcie, to chemiczne żarty!), a następnie stworzyć doskonałą mieszankę różnych atomów, które drobiazgowo łączą się ze sobą. W rezultacie te pełne energii i różnorodności interakcje atomowe kształtują naszą rzeczywistość. Tak więc, następnym razem, gdy spojrzysz na coś w swoim otoczeniu, pomyśl: „to wszystko dzięki interakcjom atomowym!”
| Rodzaj wiązania | Opis | Przykład |
|---|---|---|
| Wiązania kowalencyjne | Atom dzieli się swoimi elektronami z innym atomem. | Węgiel tworzy organiczne związki. |
| Wiązania jonowe | Jeden atom "pożycza" elektron od drugiego, tworząc jony. | Powstawanie soli. |
Czy wiesz, że węgiel, który jest podstawowym budulcem życia na Ziemi, może utworzyć nawet cztery wiązania kowalencyjne z innymi atomami, co sprawia, że jest niezwykle elastyczny w tworzeniu skomplikowanych związków organicznych?
Historia badań nad atomem: od teorii Daltona do nowoczesnej fizyki kwantowej
Historia badań nad atomem sięga czasów, gdy John Dalton postanowił wkroczyć na scenę naukową i zdefiniować atomy jako kulki. Zakładał, że są one jednorodne i, co najważniejsze, niepodzielne, podobnie jak kule w grze bilardowej. Nikt wówczas nie przypuszczał, że z czasem te kulki zyskają swoje drobinki, które będą rywalizować o tytuł „najmniej podzielnej”. Dalton stawiał czoła niemal wszystkim wątpliwościom, a jego odkrycia stały się fundamentem dla przyszłych badań. Szczerze mówiąc, nikt nie myślał, że te małe kulki mają swoje osobowości, a każda z nich otacza się 'przyjaciółmi' i 'rodziną' w postaci elektronów, protonów i neutronów.
W miarę upływu czasu, badacze zaczęli dostrzegać, że atomy oraz kulki nie są jedynymi graczami na tym boisku. J.J. Thomson wkroczył do akcji i odkrył elektron, budując model atomu przypominający ciasto z rodzynkami. Cukierki, a mówiąc precyzyjniej – elektrony, krążyły wokół masy dodatniej, nie zdając sobie sprawy, że czeka je wielka przygoda z Rutherfordem. W kolejnych latach ten ostatni, dzięki swoim eksperymentom, zauważył, że najważniejsze jest jądro atomowe – takie małe, ale z ogromną mocą. Kto by pomyślał, że nasze małe „kulki” skrywają tak wiele tajemnic w swoich wnętrzach?
Od planet do fal
Kluczowym momentem na drodze do współczesnego zrozumienia atomu stała się koncepcja Nielsa Bohra. Przedstawił on model, w którym elektrony krążą po orbitach podobnych do planet krążących wokół Słońca. W początkach tego odkrycia radość trwała krótko, gdyż szybko nadejście fali zmian w teorii kwantowej doprowadziło do wprowadzenia modelu Schrödingera, który zburzył dotychczasowe pojęcia o atomach. Uznał, że zamiast konkretnych orbit, powinniśmy mówić o chmurach elektronowych. Od tej chwili nikt nie mówił już o kulkach czy planetach. Atom stał się … falowy! Jakby tego było mało, do tej koncepcji dodano kwarki – cząstki, które składają się na protony i neutrony, a które zawsze tworzą grupy, nie mając szansy na samodzielne istnienie. Tak jak w wielkiej rodzinie – raz skłócone, raz zbierające się z powrotem w całość.
W ten sposób przeszliśmy od Daltona, przez Thomsona i Rutherforda, aż do Bohra i Schrödingera. Dziś rozumiemy atomy jako niezwykle skomplikowane struktury, w których każdy z elementów pełni kluczową rolę. Przez wieki ci „miniaturowi” bohaterowie nauki ewoluowali, ale jedno jest pewne – bez nich nie mielibyśmy dzisiaj nawet kawałka tortu, którym moglibyśmy się rozkoszować podczas rocznicy ich odkryć. Oto historia atomów – pełna zwrotów akcji, napięcia i niespodzianek!
Poniżej przedstawiam kilka kluczowych postaci w historii badań nad atomem oraz ich odkrycia:
- John Dalton - zdefiniował atomy jako niepodzielne kulki.
- J.J. Thomson - odkrył elektron, proponując model atomu z 'ciastem z rodzynkami'.
- Ernest Rutherford - zidentyfikował jądro atomowe jako kluczowy element atomu.
- Niels Bohr - wprowadził model atomu z orbitalami elektronowymi.
- Erwin Schrödinger - opracował model chmur elektronowych, rewolucjonizując pojęcie atomu.