Życie chemika to ciągłe zmagania z równaniami chemicznymi, które towarzyszą każdej reakcji. Zanim jednak rozpoczniesz pisanie skomplikowanych formuł, warto najpierw zrozumieć podstawowe znaki i symbole chemiczne. Można to porównać do gotowania bez znajomości przepisów! Dlatego najlepiej zacząć od opanowania najważniejszych pierwiastków. Dla ułatwienia warto przywołać smaczne wyobrażenia, które umilą naukę. Na przykład H oznacza wodór, O to tlen, a Na to sód – bo kto nie chciałby mieć trochę soli w swoich równaniach?
Symbole chemiczne - klucz do sukcesu
Teraz, gdy znasz już podstawowe symbole, czas zająć się zapisem równań. Każde równanie chemiczne przypomina przepis na eliksir. Po jednej stronie znajdziesz składniki (substraty), a po drugiej rezultaty (produkty). Kluczową zasadą pozostaje zachowanie równowagi – ilość atomów pierwiastków po obu stronach równania musi być identyczna. Chemia to nie gra w Monopoly; tutaj żaden atom nie może zniknąć bez śladu. Gdyby tak się stało, chemicy szybko straciliby rachunek na wykładach. Zanim zatem rozpoczniesz swoje wielkie chemiczne przygody, pamiętaj, że zbilansowanie to podstawa sukcesu.
Wyskakujące błędy, czyli rzecz o pułapkach
Nie zapominajmy o błędach, które mogą ukraść pewność siebie podczas pisania równań. Na przykład zmiana indeksów zamiast dodawania współczynników czy pomijanie "jedynki" to popularne gafy. Wyobraź sobie, że każdy doświadczony kucharz wie, że można zepsuć wiele potraw, dodając zbyt wiele składników. Dlatego baw się i testuj różne równania chemiczne, wprowadzaj poprawki oraz pamiętaj o tej zabawnej regule: jeśli za dużo, to natychmiast mniej, bo reakcje chemiczne mają swoje zasady!
Opanowanie tajników pisania równań chemicznych okazuje się nie tylko przydatne, ale także fascynujące. Jak w każdej dziedzinie, im więcej praktykujesz, tym lepiej ci idzie. Dzięki temu odkryjesz magiczny świat chemii od środka i zamienisz swoje obawy w pewność siebie. Zatem do dzieła – czas rozwijać swoje umiejętności chemiczne, a kto wie, może niedługo staniesz się alchemikiem współczesnych czasów!
Praktyczne wskazówki dotyczące bilansowania reakcji chemicznych
Bilansowanie reakcji chemicznych stanowi sztukę, która przypomina taniec – czasem zgrany, innym razem nieco chaotyczny. Zanim jednak rozpoczniesz swoją przygodę na chemicznym parkiecie, warto opanować kilka prostych kroków, które umożliwią Ci łatwe zapisywanie reakcji. Na początku skup się na identyfikacji reagentów oraz produktów. Lewa strona równania symbolizuje Twoje "wszystko, co wchodzi do tańca", natomiast prawa strona to "wszystko, co z niego wychodzi". Pamiętaj, że nigdy nie możesz wprowadzić do tańca jednego reagentu bez drugiego – muszą one współgrać, aby powstał przełomowy hit!
Gdy ustalisz rôl tancerzy, przejdź do bilansowania! To kluczowy moment, w którym sprawdzasz, ilu tancerzy – czyli atomów – posiadasz po obu stronach równania. Aby równanie było poprawnie zbilansowane, liczba atomów każdego pierwiastka musi być taka sama. Wprowadź odpowiednie współczynniki – to jak dodanie nowych tancerzy do pary, aby wszystko było zharmonizowane. W skrócie: jeśli poruszają się w rytm równania, wszystko będzie pięknie zgrane. Nie obawiaj się używać współczynników – pamiętaj, że nawet "jedynka" ma swoje znaczenie, więc czasami warto ją też wpisać!
Najczęstsze pułapki podczas bilansowania równań
Podczas pisania równań, niektórzy uczniowie wpadają w różne śmieszne pułapki, ponieważ zamiast koncentrować się na bilansowaniu atomów, zaczynają modyfikować indeksy w związkach chemicznych. Pamiętaj, że to nie jest "McGyver" w akcji! Zamiast zmieniać chemiczne zasady, korzystaj z współczynników, które stanowią klucz do zbalansowania reakcji. Nie zapomnij także o oznaczaniu stanów skupienia Twoich bohaterów – dzięki temu zyskają one dodatkowy styl. Bez odpowiednich oznaczeń (s), (l) czy (g), Twoje równanie będzie przypominać bal u szewca, któremu brakuje butów!
Na koniec, niech nie umknie Ci zasada zachowania masy – pamiętaj, że suma mas reagentów oraz produktów powinna być równa. Poniżej wymienione są najważniejsze aspekty, które warto mieć na uwadze przy bilansowaniu reakcji:
- Kontroluj liczbę atomów dla każdego pierwiastka po obu stronach równania.
- Wprowadzaj odpowiednie współczynniki, aby zharmonizować równanie.
- Oznaczaj stany skupienia reagentów i produktów odpowiednimi symbolami.
- Nie zmieniaj indeksów w związkach chemicznych – używaj współczynników.

Jeśli uda Ci się zbilansować reakcję bez żadnych błędów, serdeczne gratulacje! Możesz śmiało uznać się za chemiczną gwiazdę, gotową do podboju nie tylko parkietu, ale także całego chemicznego świata. Niech Twoja chemiczna przygoda będzie pełna ekscytujących doświadczeń, a w zakresie równań nigdy nie przestawaj ćwiczyć!
Najczęstsze błędy w pisaniu równań – jak ich unikać?
Każdy, kto miał do czynienia z chemią, doskonale wie, jak frustrujące mogą być błędy w pisaniu równań chemicznych. To przypomina sytuację, w której próbujemy stworzyć wiersz, ale zamiast rymów brakuje nam kluczowych spójników! Co więcej, nieodpowiednie równania potrafią zabrać całą radość o odkrywaniu, co wydarzyło się w laboratorium. Dlatego warto poświęcić chwilę na zrozumienie znaczenia tych formułek oraz na naukę, jak unikać najczęstszych potknięć.
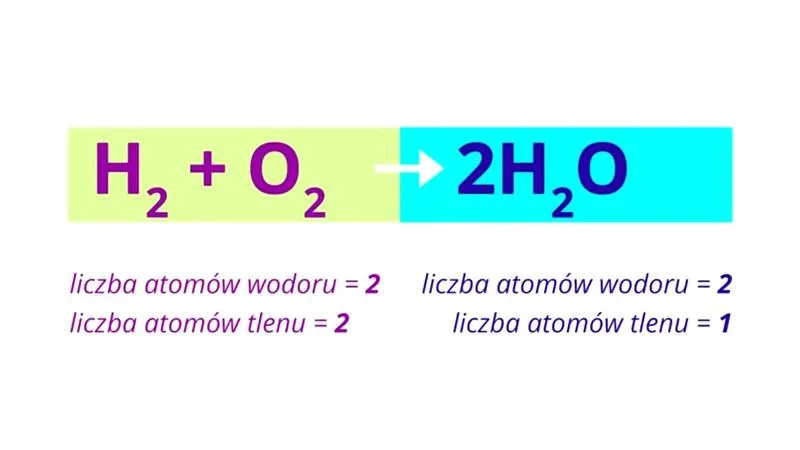
Na początek, najwięksi wrogowie porządku w równaniach chemicznych to niewłaściwe wzory związków chemicznych. Czasami uczniowie, próbując uprościć swoje zadania, wpisują jakiekolwiek literki i myślą, że to wystarczy. To tak, jakby chciało się zamówić pizzę, pisząc zamówienie w języku obcym, którego się nie zna! Dobrze zatem znać podstawowe wzory, zanim zaczniemy organizować chemiczne pomieszczenie. Dlatego warto poświęcić chwilę na powtórkę, bo zapomnienie tych wzorów to jak zgubienie kluczy do domu – nie wyjdziemy stamtąd, dopóki nie odnajdziemy pomocy!
Najczęstsze błędy w zapisie równań chemicznych

Innym problemem, który wpływa na prawidłowy zapis równań, jest pomijanie „jedynki” podczas bilansowania. Niech ktoś przypomni uczniom, że jedynki również mają swoje miejsce! Warto zapisywać 1H₂O czy 1NaCl, a nie przywiązywać się do zasady „nie pisz jednostek”, jakby to była jakaś fałszywa zasada algebraiczna. Chcemy być uczciwi wobec naszego równania, prawda? Każdy atom zasługuje na szacunek i uwzględnienie!
Na koniec, warto przypomnieć o współczynnikach. Często uczniowie mylą indeksy ze współczynnikami – to tak, jakby próbowali wzmocnić kawę rumiankiem! Aby skutecznie zbilansować równania, należy dodawać współczynniki, a nie bawić się w zmianę indeksów. Postarajmy się traktować nasze równania jak przepisy kulinarne – przynajmniej jedna łyżka cukru na filiżankę kawy ułatwia życie i nie wywołuje koszmarów. Podsumowując, wprowadzając do naszej chemicznej telenoweli kilka zasad, stworzymy niezwykle emocjonującą akcję, a równania staną się bliskie ideałom! Znajdźmy radość w tych formułach, a nie pułapkach!
| Błąd | Opis | Jak unikać |
|---|---|---|
| Niewłaściwe wzory związków chemicznych | Wpisywanie losowych liter zamiast prawidłowych wzorów chemicznych. | Znajomość podstawowych wzorów chemicznych oraz ich powtórka przed napisaniem równania. |
| Pomijanie "jedynki" podczas bilansowania | Zapominanie o konieczności zapisywania 1H₂O czy 1NaCl w równaniach. | Przypominanie sobie, że jedynki również mają swoje miejsce i są istotne dla poprawności równania. |
| Mieszanie indeksów ze współczynnikami | Nieprawidłowe stosowanie indeksów zamiast współczynników do bilansowania równań. | Traktowanie równań jak przepisy kulinarne i dodawanie współczynników, a nie zmiana indeksów. |
Czy wiesz, że niektóre równań chemicznych można zapisać w różny sposób, jednak wszystkie muszą być zgodne z zasadą zachowania masy? Oznacza to, że na poziomie atomowym liczba atomów przed reakcją musi równać się liczbie atomów po reakcji, co jest kluczowe dla poprawnego zbilansowania równania.
Rola stanów skupienia w równań chemicznych – co warto wiedzieć?
Równania chemiczne stanowią sposób, w jaki chemicy obrazują, co zachodzi podczas reakcji. Można to porównać do kulinarnego przepisu, w którym składniki, zwane substratami, łączą się, tworząc pyszne dania, czyli produkty. Jednak zastanówmy się chwilę, czy każde danie możemy przyrządzić w dowolnym naczyniu? Oczywiście, że nie! W tym kontekście kluczową rolę odgrywają stany skupienia, które przypominają przyprawy w kuchni. Są one niezbędne, aby uzyskać idealne smaki, a w naszym przypadku pozwalają zrozumieć, co konkretnie dzieje się podczas reakcji chemicznych. Ignorowanie ich sprawia, że równania stają się chaotyczne, niczym nieudane ciasto drożdżowe!
W chemii wyróżniamy cztery podstawowe stany skupienia: stały (s), ciekły (l), gazowy (g) oraz rozpuszczony w wodzie (aq). Oznaczenie tych stanów w równaniach chemicznych umożliwia lepsze zrozumienie procesów zachodzących w probówce. Wyobraź sobie, że przeprowadzisz eksperyment i, nieświadomie, wymieszasz sól z wodą, a następnie poczujesz się jak odkrywca, gdy stworzona zostanie solanka! Właściwe zaznaczenie stanów skupienia pokazuje, że sól znajdowała się w stanie stałym (s), a woda była w stanie ciekłym (l). Ich harmonijne połączenie dało w efekcie smaczną solankę zamiast nieprzyjemnej brei. Umiejętność korzystania z tych oznaczeń przekłada się na profesjonalizm, a nasze równania nabierają artystycznego wyrazu!
Dlaczego stany skupienia są kluczowe?

Stany skupienia nie są jedynie kolejną nudną zasadą chemiczną – one naprawdę wprowadzają różnicę! Na przykład, w czasie reakcji tlenku węgla z tlenem powstaje dwutlenek węgla. Ta sama reakcja, przeprowadzona w różnych warunkach, na przykład ciśnienia i temperatury, może przynieść całkowicie inne produkty! Dlatego podczas pisania równań chemicznych nie należy zapominać o wskazaniu stanów skupienia. Zaniedbanie tego szczegółu może prowadzić do nieporozumień, które przypominają tragiczną farsę na scenie: niby chemia, a jednak nie! Każdy chemik pragnie, aby jego eksperiment był spektakularny, a nie chaotyczny!
W tabeli poniżej wymienione są podstawowe stany skupienia w chemii:
- Stały (s)
- Ciekły (l)
- Gazowy (g)
- Rozpuszczony w wodzie (aq)
Podsumowując, zapisywanie równań chemicznych to nie tylko technika, ale także sztuka, w której stany skupienia mają znaczącą rolę. Zrozumienie tych ważnych szczegółów czyni nas lepszymi chemikami i otwiera drzwi do nieskończonych możliwości w laboratorium. A kto wie, być może pewnego dnia, dzięki doskonałym równaniom, odkryjesz sposób na mały chemiczny cud? Dlatego nie zniechęcaj się tymi literami – jak mówią, im więcej próbujesz, tym więcej słodkiego smaku w końcu odnajdziesz!
Źródła:
- https://www.polecanekorepetycje.pl/zasady-pisania-rownan-reakcji-chemicznych/
- https://zskrzymow.pl/odkryj-sztuke-pisania-rownan-chemicznych-poradnik-dla-poczatkujacych
- https://opracowania.pl/opracowania/chemia/rownania-reakcji-chemicznych,oid,2173
Pytania i odpowiedzi
Jakie są podstawowe symbole chemiczne, które warto znać?
Podstawowe symbole chemiczne to klucz do zrozumienia równań chemicznych. H oznacza wodór, O to tlen, a Na to sód, co ułatwia naukę i zapamiętywanie najważniejszych pierwiastków.
Dlaczego bilansowanie reakcji chemicznych jest istotne?
Bilansowanie reakcji chemicznych jest kluczowe, ponieważ ilość atomów pierwiastków musi być taka sama po obu stronach równania. Zachowanie równowagi sprawia, że równania są poprawne i zgodne z zasadą zachowania masy.
Jakie błędy najczęściej popełniają uczniowie podczas pisania równań chemicznych?
Uczniowie najczęściej popełniają błędy związane z niewłaściwymi wzorami związków chemicznych lub pomijają "jedynkę" w bilansowaniu. Innym częstym błędem jest mieszanie indeksów ze współczynnikami, co prowadzi do niepoprawnych równań.
Jakie jest znaczenie stanów skupienia w równań chemicznych?
Stany skupienia, takie jak stały, ciekły czy gazowy, są niezbędne do prawidłowego zrozumienia procesów chemicznych. Oznaczenie tych stanów w równaniach umożliwia lepsze zobrazowanie zachodzących reakcji.
Jakie praktyczne kroki można podjąć, aby poprawić pisanie równań chemicznych?
Praktyczne kroki obejmują identyfikację reagentów i produktów, a następnie bilansowanie równania poprzez dodawanie odpowiednich współczynników. Ważne jest również, aby nigdy nie zmieniać indeksów w związkach chemicznych, a zamiast tego używać współczynników dla zharmonizowania równań.







